Substâncias.
Uma substância é formada por átomos de elementos específicos em proporções específicas. Cada substância possui um conjunto definido de propriedades
e uma composição química. Elas também podem ser inorgânicas (como a água e
os sais minerais)ou orgânicas (como a proteína, carboidratos, lípides, ácido nucleico
e vitaminas).
Substâncias químicas.
Os átomos ligados, ou seja, as moléculas,
representam o que chamamos de substância química, cada uma identificada
por uma fórmula química como, por exemplo, H2O, que representa a
substância água e indica que sua composição é de dois átomos do elemento
hidrogênio e um átomo do elemento oxigênio.
Podemos perceber algumas coisas:
O2 - é a fórmula da substância
oxigênio, composta por dois átomos, ambos do elemento oxigênio.
CO2 - é a fórmula da substância
dióxido de carbono, composta por três átomos, sendo dois do elemento oxigênio e
um do elemento carbono.
C6H6 - é a fórmula da substância
benzeno, composta por 12 átomos, sendo seis do elemento carbono e seis do
elemento hidrogênio.
Substância
simples.
Uma substância é classificada como simples quando sua molécula é formada por um único tipo de elemento,
independentemente do número de átomos que possui. Substâncias cujas moléculas
são formadas por dois ou mais elementos químicos são chamadas de compostas.
Retomando o exemplo, teremos:
O2 - Substância
simples
CO, CO2, NaCl, H2O
- Substâncias compostas
Substâncias
puras.
Substâncias são consideradas puras quando
em uma amostra só encontramos moléculas daquela substância, sem nenhuma
outra presente.
Por exemplo: na água destilada encontramos
única e exclusivamente moléculas da substância água (H2O). Mesmo a
água sendo uma molécula triatômica e composta (possui os elementos H e O), essa
amostra é de uma substância pura.
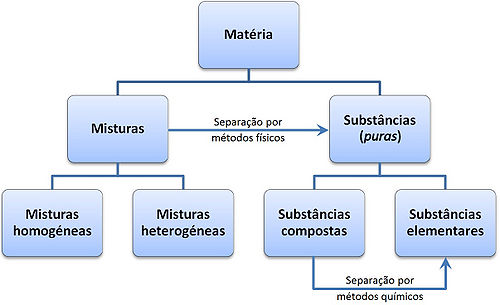
Misturas.
Mistura é um material que reúne duas ou
mais substâncias, sem que ocorram alterações nelas, mantendo-se portanto, as
características e propriedades das substâncias envolvidas. As misturas podem
ser divididas em :
Mistura homogênea – é aquela
que apresenta as mesmas propriedades em to qualquer parte da sua extensão,
apresenta apenas uma fase, é portanto, monofásica.
Exemplo: água + álcool;
Exemplos:
*Evaporação: separa líquido do sólido. Quando exposta ao ar e sob
temperatura ambiente, a parte líquida da mistura evapora-se, enquanto a parte
sólida fica depositada.
*Destilação: líquido do sólido.
*Destilação fracionada: vários líquidos cujos pontos de ebulição sejam
diferentes. O aparelho é o mesmo da destilação simples, contendo apenas um
termômetro a mais. A mistura é aquecida e os líquidos vão destilando na ordem
crescente de seus pontos de ebulição.
*Solidificação fracionada: baseia-se no ponto de solidificação das substâncias,
quando as duas estão dissolvidas num mesmo líquido.
*Fusão fracionada: usada para separar substâncias contidas numa mistura sólida,
baseia-se no de que o ponto de fusão é uma temperatura característica de cada
sólido.
*Sublimação: aplica-se a substâncias que passam diretamente do estado sólido
para o estado de vapor. Recolhe-se os seus vapores e depois os mesmos são
sublimados, separando-se do restante da mistura.
*Liquefação e vaporização fracionada: misturas constituídas por vários gases.
Em aparelhagem especial a solução gasosa é continuamente resfriada e à medida
que os pontos de liquefação dos componentes vão sendo atingidos os mesmos vão
passando ao estado líquido. A seguir são submetidos à evaporação fracionada,
separando-se dessa maneira os vários gases.
Mistura heterogênea – é aquela que não apresenta as
mesmas propriedades em todas as partes de sua extensão, apresentam duas ou mais fases, podendo ser: bifásica,
trifásica ou polifásica.
Exemplo: água + óleo, bifásica;
Exemplos:
*Catação: separar sólidos. Consiste em separar com uma pinça ou simplesmente
com a mão, os fragmentos quando estes forem grandes e diferentes.
*Ventilação: separar os sólidos. Consiste na separação de uma das fases
submetendo a mistura a uma corrente de ar; só pode se usada quando uma das
fases é muito leve em relação a outra, ou seja possuem densidades diferentes.
*Levigação: separação de sólidos. A mistura é submetida a uma corrente líquida
(água). Um dos componentes sendo muito mais leve que o outro é arrastado pela
correnteza e o outro fica.
*Flotação: substâncias sólidas de densidades diferentes. Coloca-se um líquido
de densidade intermediária na mistura. Isso faz com que o líquido separe as
substâncias: a de menor densidade fica na superfície do líquido e a de maior densidade
abaixo.
*Peneiração ou tamização: pode ser usado quando as fases do sistema se reduzem
a grãos de diferentes tamanhos quando o sistema é triturado; por meio de uma
série de peneiras cujas malhas são gradativamente menores pode-se


Nenhum comentário:
Postar um comentário
"Pedra no caminho?
Guardo todas,
um dia vou construir um castelo..."
Fernando pessoa.